治療指針(重症度分類・疾患活動性指標)
I. キャッスルマン病の治療指針
キャッスルマン病の診断
キャッスルマン病の診断には、病理診断が必須である。原則として、リンパ節の病理診断を行う。身体所見、全身のCTあるいはFDG-PET(保険適用外)によりリンパ節病変のサイズや分布を評価し、生検するリンパ節を選定する。
本研究班のキャッスルマン病の診断基準案1,2)
AおよびBを満たすものをキャッスルマン病と診断する。
A 以下の2項目を満たす。
2. リンパ節または臓器の病理組織所見が、下記のいずれかのキャッスルマン病の組織像に合致する。
- 1) 硝子血管型
- 2) 形質細胞型
- 3) 硝子血管型と形質細胞型の混合型
B リンパ節腫大の原因として、以下の疾患が除外できる。
1. 悪性腫瘍
血管免疫芽球性T細胞性リンパ腫、ホジキンリンパ腫、濾胞樹状細胞肉腫、腎がん、悪性中皮腫、肺がん、子宮頸がんなど。
2. 感染症
非結核性抗酸菌症、ねこひっかき病、リケッチア感染症、トキソプラズマ感染症、真菌性リンパ節炎、伝染性単核球症、慢性活動性EBウイルス感染症、急性HIV感染症など。
3. 自己免疫疾患
SLE、関節リウマチ、シェーグレン症候群など。
4. その他の類似した症候を呈する疾患
IgG4関連疾患¶、組織球性壊死性リンパ節炎、サルコイドーシス、特発性門脈圧亢進症など。
診断に際しての参考事項
- 自覚症状は、無症状のものから重篤なものまで様々である。頻度の高い症状として、微熱~中等度の発熱、全身倦怠感、易疲労感、体重減少、盗汗、リンパ節腫脹がある。一部の症例では皮疹(扁平ないし軽度隆起した褐色~暗赤色の皮疹、類天疱瘡、キサントーマ、アトピー性皮膚炎、黄色腫、血管腫)、腹満、浮腫、息切れ、呼吸困難感、出血傾向がみられる。ときに脳梗塞などの血栓症や、末梢神経障害を認める。
- 画像検査では、リンパ節腫脹のほかに、肝脾腫や、胸水、腹水、間質性の肺陰影をみとめることがある。
- 血液検査では、多くの場合に炎症反応(CRP)が陽性で、血中のIL-6濃度の上昇がみられる。また、小球性貧血、血小板増多、血清LDH低値、低アルブミン血症、高アルカリホスファターゼ血症、多クローン性の高ガンマグロブリン血症、高IgE血症、高VEGF血症を呈することが多い。また、しばしば抗核抗体などの自己抗体が陽性となる。
- 一部の症例では腎障害(蛋白尿、血清クレアチニン値上昇)、間質性の肺病変、肺高血圧症、拡張型心筋症、自己免疫性の血小板減少症、自己免疫性溶血性貧血、内分泌異常(甲状腺機能低下症など)、アミロイドーシスを合併する。
- 高ガンマグロブリン血症にともなって血清IgG4高値や組織中IgG4陽性細胞増多を示すことがある。その際に、発熱、CRP高値、小球性貧血、血小板増多などの高IL-6血症に伴う反応が認められる場合は、IgG4関連疾患よりもキャッスルマン病の可能性を強く考える。
- HHV-8関連のキャッスルマン病は、特徴的なリンパ節組織像と、リンパ節組織中あるいは血中におけるHHV-8の存在を証明することによって診断する。多くはHIV感染者に見られ、カポジ肉腫や悪性リンパ腫を合併することも多い。
- POEMS症候群は、単クローン性のガンマグロブリン血症をともなう進行性のポリニューロパチーで、多発性骨髄腫類縁のリンパ系腫瘍と考えられるが、その一部がキャッスルマン病と重なる病態を呈する。治療法や予後は異なるが、本診断基準では除外すべき疾患には含めない。
- TAFRO症候群は、血小板減少、全身性の浮腫、発熱、骨髄の線維化、肝脾腫を特徴とした臨床像から提唱された疾患概念である。キャッスルマン病に合致するリンパ節病理組織像がみられることがあり、特発性多中心性キャッスルマン病との異同が議論されている。現時点では除外すべき疾患には含めない。
臨床的病型分類1,2)
病変が1つの領域に限局する単中心性(限局型; unicentric Castleman disease, UCD)と、複数の領域に広がる多中心性(multicentric Castleman disease, MCD)が区別される。MCDはさらに、ヒト・ヘルペスウイルス8型(human herpesvirus-8, HHV-8; カポジ肉腫関連ヘルペスウイルス Kaposi's sarcoma-associated herpesvirus, KSHVとも呼ばれる)の感染によるHHV-8関連MCDと、HHV-8感染のみられない特発性MCD(idiopathic MCD, iMCD)に分類される(下図)。
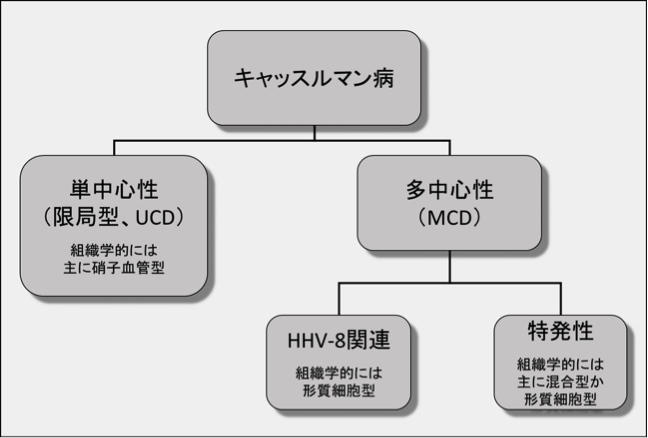
Castleman Disease Collaborative Network(CDCN)による病型分類とiMCDの診断基準
CDCNでは、POEMS症候群を独立させて、病理組織分類もふまえた下図のようなキャッスルマン病の病型分類を提唱している3)。
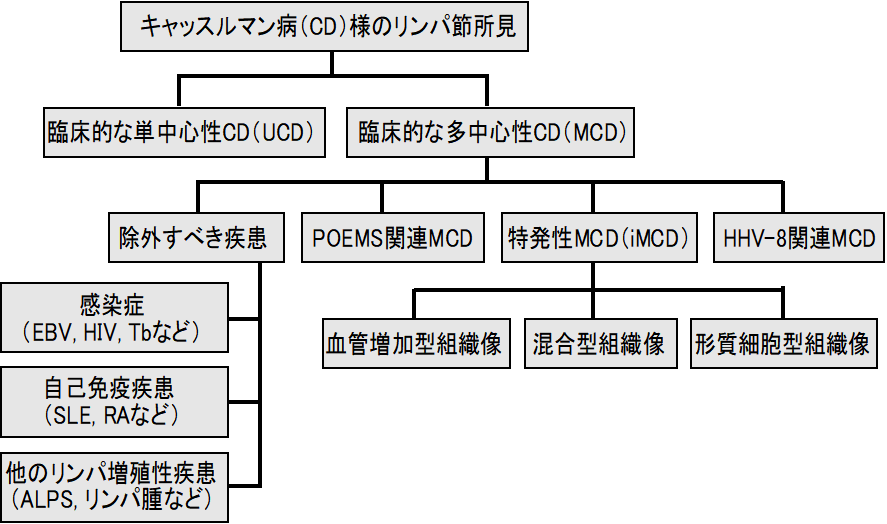
このうち、iMCDに関しては、下記のような国際診断基準が提唱されている3)。
CDCNによるiMCDの国際診断基準
大基準2つを満たし、小基準11項目のうち少なくとも1項目の検査基準を含む2項目以上を満たし、かつ除外基準にある疾患が除外される場合にiMCDと診断される。
- ・ iMCD に合致するリンパ節病理組織所見
- ・ 腫大(>1cm)した2か所以上のリンパ節
- ・ 検査基準
- 1. CRP (>1 mg/dL) または ESR (>15 mm/h)上昇
- 2. 貧血 (男性Hb<12.5 g/dL, 女性Hb<11.5 g/dL)
- 3. 血小板増加(<15万/μL)または血小板増多(>40万/μL)
- 4. 低アルブミン血症(<3.5 g/dL)
- 5. 腎障害(eGFR<60 mL/min/1.73m2, 蛋白尿 >150 mg/日 or >10 mg/dL)
- 6. 多クローン性高γグロブリン血症(総γグロブリン or IgG>1700 mg/dL)
- ・ 臨床的基準
- 7, 全身症状: 盗汗、38度以上の発熱、体重減少(B症状)
- 8. 肝臓または脾臓の腫大
- 9. 体液貯留: 浮腫、腹水、胸水
- 10, 発疹性サクランボ色血管種症または紫紅色丘疹
- 11. リンパ球性間質性肺炎
- 1. 感染症
- ①HHV8(免疫組織染色でLANA1陽性であればHHV8関連MCDと診断される)
- ②伝染性単核球症や慢性活動性EBウイルス感染症などのEBウイルス関連リンパ増殖性疾患(低レベルのEBウイルスの検出だけでは必ずしもリンパ増殖性疾患として除外できない)
- ③制御されていない他の感染症(サイトメガロウイルス感染症、トキソプラズマ症、HIV、活動性結核など)
- 2. 自己免疫疾患や自己炎症性疾患(診断基準を満たすもの。自己抗体の検出のみでは自己免疫疾患として除外されない)
- ①全身性エリテマトーデス
- ②関節リウマチ
- ③成人スティル病
- ④若年性特発性関節炎
- ⑤自己免疫性リンパ増殖性疾患
- 3. 悪性疾患やリンパ増殖性疾患
- ①悪性リンパ腫
- ②多発性骨髄腫
- ③原発性リンパ節形質細胞腫
- ④濾胞樹状細胞肉腫
- ⑤POEMS症候群
-
- 4. 診断には必要ないが診断を支持する所見
- ・IL-6、sIL-2R、VEGF、IgA、IgE、LDH、β2マイクログロブリンの上昇
- ・骨髄の細網線維の増生(特にTAFRO症候群の場合)
- ・iMCDと関連する疾患:腫瘍関連天疱瘡、BOOP、自己免疫性血球減少症、多発性神経障害(POEMS症候群を除く)、糸球体腎症、炎症性筋線維芽細胞腫瘍
重症度分類
当研究班ではキャッスルマン病の重症度を、主として生命予後に関係する臓器障害により軽症、中等症、重症の3段階に分類する案を作成している。なお、2018年6月9日の当研究班の班会議において、臨床血液に掲載された「キャッスルマン病診療の参照ガイド」およびModern Rheumatologyに掲載された論文の重症度分類から若干修正を行い、最新の重症度分類案を下記に示す。暫定的な案であり、ご意見をいただければ幸いである。
| 重症 | 中等症 | 軽症 | |
|---|---|---|---|
| 炎症性貧血 | Hb <7g/dL または赤血球輸血依存性 | 7 g/dL ≤Hb <8 g/dL | 左記の いずれも 該当無し |
| 血小板減少 | 血小板輸血不応 または血小板輸血依存性 |
血小板数 <2万/μL | |
| 低Alb血症 | Alb <1.5 g/dL | 1.5 ≤Alb <2.0 | |
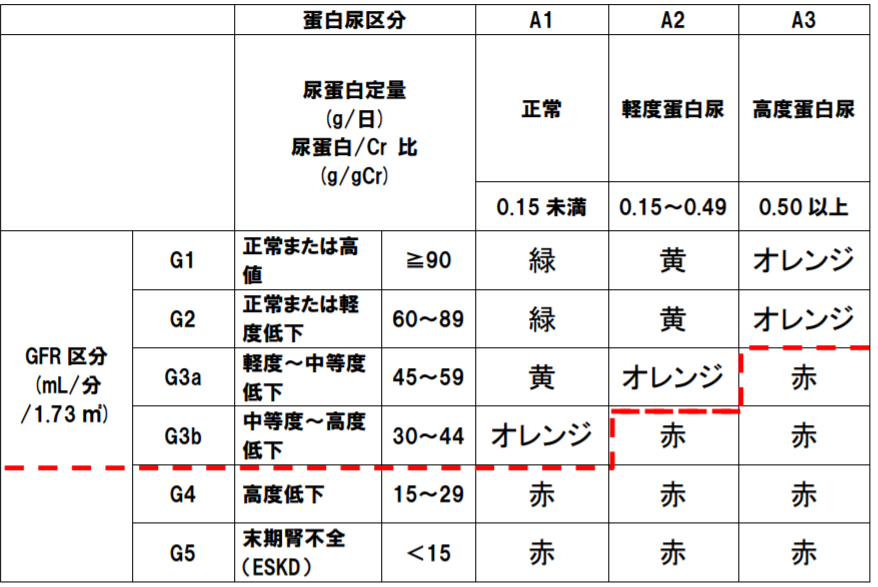
| 腎機能障害 | GFR <15ml/分/1.73m² またはネフローゼ症候群 |
CKD重症度分類ヒートマップで赤の部分 | |
| 肺病変 | 間質性肺陰影+ かつ 安静時酸素吸入を要する。 |
間質性肺陰影+ かつ 軽い労作で呼吸困難。 |
|
| 胸腹水 | ドレナージを要する。 | 画像上明らか。 | |
| 心不全 | EF <40% または NYHA IV度 |
40% ≤EF <50% または NYHA III度 |
|
| アミロイドーシス | 組織学的に証明された二次性アミロイドーシスによる臓器障害あり |
厚生労働省のiMCDに対する指定難病認定における医療費助成の基準は下記の通りである。
- ①~③のいずれかに該当する者を対象とする。
- ①Barthel Indexを用いて、85点以下。
- ②CKD重症度分類ヒートマップが赤の部分の場合。
- ③間質性の肺陰影がみられ、肺障害の重症度分類でⅢ度以上。
①Barthel Index
| Barthel Index | 質問内容 | 点数 | |
|---|---|---|---|
| 1 | 食事 | 自立、自助具などの装着可、標準的時間内に食べ終える | 10 |
| 部分介助(たとえば、おかずを切って細かくしてもらう) | 5 | ||
| 全介助 | 0 | ||
| 2 | 車椅子からベッドへの移動 | 自立、ブレーキ、フットレストの操作も含む(歩行自立も含む) | 15 |
| 軽度の部分介助または監視を要する | 10 | ||
| 座ることは可能であるがほぼ全介助 | 5 | ||
| 全介助または不可能 | 0 | ||
| 3 | 整容 | 自立(洗面、整髪、歯磨き、ひげ剃り) | 5 |
| 部分介助または不可能 | 0 | ||
| 4 | トイレ動作 | 自立(衣服の操作、後始末を含む、ポータブル便器などを使用している場合はその洗浄も含む) | 10 |
| 部分介助、体を支える、衣服、後始末に介助を要する | 5 | ||
| 全介助または不可能 | 0 | ||
| 5 | 入浴 | 自立 | 5 |
| 部分介助または不可能 | 0 | ||
| 6 | 歩行 | 45m以上の歩行、補装具(車椅子、歩行器は除く)の使用の有無は問わず | 15 |
| 45m以上の介助歩行、歩行器の使用を含む | 10 | ||
| 歩行不能の場合、車椅子にて45m以上の操作可能 | 5 | ||
| 上記以外 | 0 | ||
| 7 | 階段昇降 | 自立、手すりなどの使用の有無は問わない | 10 |
| 介助または監視を要する | 5 | ||
| 不能 | 0 | ||
| 8 | 着替え | 自立、靴、ファスナー、装具の着脱を含む | 10 |
| 部分介助、標準的な時間内、半分以上は自分で行える | 5 | ||
| 上記以外 | 0 | ||
| 9 | 排便コントロール | 失禁なし、浣腸、坐薬の取り扱いも可能 | 10 |
| ときに失禁あり、浣腸、坐薬の取り扱いに介助を要する者も含む | 5 | ||
| 上記以外 | 0 | ||
| 10 | 排尿コントロール | 失禁なし、収尿器の取り扱いも可能 | 10 |
| ときに失禁あり、収尿器の取り扱いに介助を要する者も含む | 5 | ||
| 上記以外 | 0 | ||
②CKD重症度分類ヒートマップ
③肺障害の重症度分類判定表
下記の重症度分類判定表に従い判定する。安静時動脈血酸素分圧が80Torr以上をI度、70Torr以上80Torr未満をII度、60Torr以上70Torr未満をIII度、60Torr未満をIV度とする。 重症度II度以上で6分間歩行時SpO2が90%未満となる場合は、重症度を1段階高くする。ただし、安静時動脈血酸素分圧が70Torr未満の時には、6分間歩行時SpO2は必ずしも測定する必要はない。
| 重症度分類 | 安静時動脈血酸素分圧 | 6分間歩行時 SpO2 |
|---|---|---|
| I | 80Torr 以上 | |
| II | 70Torr 以上 80Torr 未満 | 90 %未満の場合はIIIにする |
| III | 60Torr 以上 70Torr 未満 | 90 %未満の場合はIVにする (危険な場合は測定不要) |
| IV | 60Torr 未満 | 測定不要 |
※診断基準及び重症度分類の適応における留意事項
- 病名診断に用いる臨床症状、検査所見等に関して、診断基準上に特段の規定がない場合には、いずれの時期のものを用いても差し支えない(ただし、当該疾病の経過を示す臨床症状等であって、確認可能なものに限る。)。
- 治療開始後における重症度分類については、適切な医学的管理の下で治療が行われている状態であって、直近6か月間で最も悪い状態を医師が判断することとする。
- なお、症状の程度が上記の重症度分類等で一定以上に該当しない者であるが、高額な医療を継続することが必要なものについては、医療費助成の対象とする。
疾患活動性評価システム
当研究班では、疾患活動性の指標としてCHAPスコアを提唱している2)。これは、CRP、ヘモグロビン(Hb)、血清アルブミン、パフォーマンス・ステータス(P.S.)の各スコアを合計したもので、疾患活動性は0点から最高16点までの範囲で評価される。同一患者における病勢の変化や、治療効果判定に使用されることを想定している。
| Score | 0 | 1 | 2 | 3 | 4 |
|---|---|---|---|---|---|
| CRP (mg/dL) |
<1 | ≥1, <5 | ≥5, <10 | ≥10, <20 | ≥20 |
| Hb (g/dl) |
≥12 | <12, ≥10 | <10, ≥8 | <8 | Transfusion dependent |
| Albumin (g/dL) |
≥3 | <3, ≥2.5 | <2.5, ≥2 | <2, ≥1.5 | <1.5 |
| P. S. (ECOG) |
0 | 1 | 2 | 3 | 4 |
キャッスルマン病の治療
(1)単中心性(限局型)キャッスルマン病(UCD)
多くの場合、病変リンパ節に対する局所療法(外科的切除など)によって治癒が期待できる。治癒には完全にとりきることが重要である。外科切除後に再発した場合や、切除が困難で全身性の炎症症状がみられる場合は、特発性MCDに準じた治療を行う。
(2)特発性多中心性キャッスルマン病(iMCD)
臨床症状が軽微な場合には無治療で経過観察する場合もあるが、多くの場合、倦怠感などの症状を緩和するために治療介入が必要となる4)。全身性の炎症症状が軽度の場合には、まず低用量~中等量のステロイド(臓器症状がない場合はプレドニゾロン0.3 mg/kg程度、臓器症状がみられる場合は0.5~1 mg/kg程度)で症状の緩和を試み、症状が改善したら徐々に減量する。長期に投与を行う場合は、糖尿病や骨粗鬆症の発症、ヘルペスウイルスや真菌などによる感染症に注意が必要である。
炎症症状が強い場合や、腎や肺などに重篤な臓器障害を有する場合(重症度分類で中等症以上)には、トシリズマブ(抗インターロイキン6受容体抗体)の併用を検討する。軽症であっても、ステロイドのみでは臨床症状あるいは臓器障害の進行が十分コントロールできないと考えられる場合にも、トシリズマブの投与を考慮する。トシリズマブ治療開始に当たっては、生涯にわたって本治療の継続が必要になる可能性について患者に説明しておく。原則として8 mg/kgを2週間ごとに点滴投与する(症状により1週間まで投与間隔を短縮できる)。併存疾患などのためにステロイド治療が不適当と判断される場合には、初期治療としてトシリズマブを単独で用いてもよい。多くの場合、トシリズマブ治療を開始すると、さまざまな全身の炎症症状や検査値異常がすみやかに改善する。併用しているステロイドを減量・中止できることも多い。また、腫大していた脾臓やリンパ節も徐々に縮小する。副作用としては、頭痛、上気道炎、掻痒、皮疹、アレルギーなどがある。これらは軽微なものが多いが、肺炎や敗血症などの重篤な感染症も報告されている5,6)。トシリズマブ治療はCRPの上昇をおさえるので、感染症を見逃さないように十分な注意が必要である。アナフィラキシーは1%強の症例に認められている。トシリズマブは、いったん投与を開始すると中止しないのが原則であるが、やむを得ず中止する場合は、ステロイドを一時的に投与または増量して炎症症状のリバウンドを予防する。トシリズマブ治療を開始すると血清中のインターロイキン6濃度(保険適用外検査)が跳ね上がるが、これは、インターロイキン6が受容体に結合できずに血漿中から除去されないためである6)。
インターロイキン6に対する抗体製剤のシルツキシマブはトシリズマブに匹敵する治療効果がみられ、2014年に米国のFDAで認可された(本邦未承認)。現時点ではランダム化比較試験で有効性が確認された唯一の薬剤である7)。
副腎皮質ステロイドやtocilizumabによる治療に不応性または不耐容で病勢のコントロールが困難な場合には、ステロイドパルス療法や、悪性リンパ腫や多発性骨髄に準じた抗がん剤治療が試みられている(いずれも保険適用外)8-10)。
(3)HHV-8関連MCD
主としてHIV感染者に見られる亜型であるが、ときにHIV感染者以外にも見られる11)。現在のところ、わが国では極めてまれと考えられる12,13)。この病型は全身の炎症症状を呈して急速に進行し、しばしばカポジ肉腫や悪性リンパ腫を合併する11)。2年を超える生存は稀とされていたが、最近、高用量のジドブジン(azidothymidine, AZT) + バルガンシクロビル + リツキシマブの3剤、あるいはリツキシマブ+ リポ化ドキソルビシン+ 抗HIV薬による非常に良好な治療成績が報告されている14,15)。寛解後の維持療法としてはインターフェロンあるいは高用量AZTが用いられる。
参考文献
- 吉崎和幸, 岡本真一郎, 川端浩, et al: キャッスルマン病診療の参照ガイド. 臨床血液 58: 97-107, 2017
- Fujimoto S, Koga T, Kawakami A, et al: Tentative diagnostic criteria and disease severity classification for Castleman disease: A report of the research group on Castleman disease in Japan. Mod Rheumatol 28: 161-167, 2018
- Fajgenbaum DC, Uldrick TS, Bagg A, et al: International, evidence-based consensus diagnostic criteria for HHV-8-negative/idiopathic multicentric Castleman disease. Blood 129: 1646-1657, 2017
- Liu AY, Nabel CS, Finkelman BS, et al: Idiopathic multicentric Castleman's disease: a systematic literature review. The Lancet Haematology 3: e163-175, 2016
- Nishimoto N, Terao K, Mima T, et al: Mechanisms and pathologic significances in increase in serum interleukin-6 (IL-6) and soluble IL-6 receptor after administration of an anti-IL-6 receptor antibody, tocilizumab, in patients with rheumatoid arthritis and Castleman disease. Blood 112: 3959-3964, 2008
- 中外製薬: アクテムラ全例調査の中間報告(キャッスルマン病), 2014,http://chugai-pharm.jp/hc/ss/pr/drug/act_via0400/report/scs/PDF/20140225_act_epmpv_safe_cd.pdf,
- van Rhee F, Wong RS, Munshi N, et al: Siltuximab for multicentric Castleman's disease: a randomised, double-blind, placebo-controlled trial. Lancet Oncol 15: 966-974, 2014
- Soumerai JD, Sohani AR, Abramson JS: Diagnosis and management of Castleman disease. Cancer Control 21: 266-278, 2014
- Seo S, Yoo C, Yoon DH, et al: Clinical features and outcomes in patients with human immunodeficiency virus-negative, multicentric Castleman's disease: a single medical center experience. Blood Res 49: 253-258, 2014
- Cervantes CE, Correa R: Castleman Disease: A Rare Condition with Endocrine Manifestations. Cureus 7: e380, 2015
- Parravicini C, Corbellino M, Paulli M, et al: Expression of a virus-derived cytokine, KSHV vIL-6, in HIV-seronegative Castleman's disease. Am J Pathol 151: 1517-1522, 1997
- Kojima M, Nakamura N, Tsukamoto N, et al: Clinical implications of idiopathic multicentric castleman disease among Japanese: a report of 28 cases. Int J Surg Pathol 16: 391-398, 2008
- Kawabata H, Kadowaki N, Nishikori M, et al: Clinical Features and Treatment of Multicentric Castleman's Disease : A Retrospective Study of 21 Japanese Patients at a Single Institute. J Clin Exp Hematop 53: 69-77, 2013
- Uldrick TS, Polizzotto MN, Yarchoan R: Recent advances in Kaposi sarcoma herpesvirus-associated multicentric Castleman disease. Curr Opin Oncol 24: 495-505, 2012
- Uldrick TS, Polizzotto MN, Aleman K, et al: Rituximab plus liposomal doxorubicin in HIV-infected patients with KSHV-associated multicentric Castleman disease. Blood 124: 3544-3552, 2014
II TAFRO症候群の治療指針
1)TAFRO症候群の診断基準
- 平成27年度厚生労働科学研究費補助金(難治性疾患政策研究事業)新規疾患;TAFRO症候群の確立のための研究班(H27-難治等(難)-一般-008)
- 平成29年度 厚生労働省科学研究難治性疾患等政策研究事業・領域別研究「非癌、慢性炎症性リンパ節・骨髄異常
- を示すキャッスルマン病、TAFRO症候群その類縁疾患の診断基準、重症度分類の改正、診断・治療のガイドライン
- の策定に関する調査研究(H29-難治(難)-一般-019)」
TAFRO症候群 診断基準および重症度分類2015(2019マイナー改訂版)
【疾患概念】 TAFRO症候群は、明らかな原因なしに急性あるいは亜急性に、発熱、全身性浮腫(胸水・腹水貯留)、血小板減少を来し、腎障害、貧血、臓器腫大(肝脾腫、リンパ節腫大)などを伴う全身炎症性疾患である。既知の単一疾患に該当せず、2010年高井らによりThrombocytopenia(血小板減少症), Anasarca(全身浮腫、胸腹水), Fever(発熱、全身炎症), Reticulin fibrosis(骨髄の細網線維化、骨髄巨核球増多), Organomegaly(臓器腫大;肝脾腫、リンパ節腫大)よりTAFRO症候群(仮称)として報告され、その後に類似例の報告が相次いでいる。ステロイドやcyclosporin Aなどの免疫抑制剤、tocilizumab, rituximabなどの有効例が報告されるも、様々な治療に抵抗性の症例も存在し、全身症状の悪化が急速なため、迅速かつ的確な診断と治療が必要な疾患である。TAFRO症候群としてリンパ節生検された症例のリンパ節組織像はCastleman病様の像を呈するが、臨床像は典型的な特発性多中心性Castleman病とは大きく異なり、独立した疾患と考える専門家が多い。TAFRO症候群症例の一部はリンパ節腫大が小さいかほとんど目立たない事があり、また血小板減少に伴う出血傾向や著明な全身浮腫のためリンパ節生検が行えない症例も多い。本診断基準ではそのような実情を考慮し、リンパ節生検を必須とはしていない。ただし、悪性リンパ腫などの悪性疾患を除外するために、生検可能なリンパ節がある場合は生検するべきである。
- ・必須項目3項目+小項目2項目以上を満たす場合TAFRO症候群と診断する。
- 1.必須項目
- ①体液貯留(胸・腹水、全身性浮腫)
- ②血小板減少(10万/μl 未満)…骨髄抑制性の治療の無い状態で
- ③原因不明の発熱(37.5℃以上)または 炎症反応陽性(CRP 2 mg/dl 以上)
- 2.小項目
- ①リンパ節生検でCastleman病様(Castleman-like)の所見
- ②骨髄線維化(細網線維化) または 骨髄巨核球増多
- ③軽度の臓器腫大(肝・脾腫、リンパ節腫大)
- ④進行性の腎障害
- 3.除外すべき疾患
- ①悪性腫瘍:悪性リンパ腫、多発性骨髄腫、中皮腫など
- ②自己免疫性疾患:全身性エリテマトーデス(SLE)、Sjögren症候群、ANCA関連血管炎など
- ③感染症:抗酸菌感染、リケッチア感染、ライム病、重症熱性血小板減少症候群(SFTS)など
- ④POEMS症候群
- ⑤IgG4関連疾患
- ⑥肝硬変
- ⑦血栓性血小板減少性紫斑病(TTP)/溶血性尿毒症症候群(HUS)
- ・TAFRO症候群では、多クローン性高γグロブリン血症は稀である
- IgGが 3,000mg/dlを超えることは稀であり、超えている症例はむしろiMCDの重症型を考慮する。
- ・明らかなMタンパクは認めない。Mタンパクを認める症例は、POEMS症候群との鑑別が問題となる。
- POEMS症候群では多発ニューロパチーが必須であり、その有無が鑑別のために重要である。
- ・血清LDHは低下〜正常値内に留まる症例が多く、増加する事は稀である。
- LDHが増加している症例は悪性リンパ腫の可能性が高く、可溶性IL-2レセプターなどその他の腫瘍マーカー、
- 画像所見の再確認が必要である。特に血管内大細胞型B細胞リンパ腫(IVLBCL)は同様の徴候を呈しうるため、
- 可能性が否定できなければ積極的に骨髄穿刺・生検、ランダム皮膚生検を行う事を推奨する。
- ・血清ALPは高値を呈する例が多い。
- ・肝脾腫はCT画像で評価できる程度のものが多く、巨大なものは悪性リンパ腫などを疑う所見である。
- ・リンパ節腫大は直径1.5cm未満程度のものが多く、大きなリンパ節病変は悪性リンパ腫などを疑う所見である。
- ・現時点ではキャッスルマン病は「除外すべき疾患」としない。
- ・免疫性血小板減少症(ITP)も、現時点では「除外すべき疾患」とはしない。
- ・自己免疫疾患の除外鑑別のために、RF、抗核抗体、抗SS-A抗体、MPO-ANCA (P-ANCA), PR3-ANCA (C-ANCA) は
- 検索すべきであり、必要に応じてその他の特異的自己抗体を追加検索する。
- ・結核など抗酸菌感染症の除外も重要である。結核感染症を除外するため、結核菌特異的インターフェロン-γ産生能
- (クオンティフェロン®️)あるいはT-SPOT法、胸水中ADA測定などを推奨する。
- ・胸水や腹水穿刺では著明な全身浮腫に伴い、基準上は漏出性と判断される例も多い。しかし、胸水や腹水中のIL-6,
- VEGFなどのサイトカインは血中濃度よりも高値を示し、漿膜炎が起こっている根拠と考えられている。(IL-6, VEGF
- 測定は保険未承認)
2)TAFRO症候群の重症度分類・疾患活動性指標
同研究班より重症度分類も公表されており、これを用いて治療効果判定や疾患活動性を評価できる。
TAFRO症候群 重症度分類2015(2019マイナー改訂版)
- 症候毎にスコアをつけ、その合計点にて分類する。
- 本重症度分類は、疾患活動性スコアとしても使用できる。
①体液貯留… 合計3点満点
- 画像上で明らかな胸水;1点
- 画像上で明らかな腹水;1点
- 身体所見上明らかな全身性浮腫(圧痕+);1点
②血小板減少… 3点満点
- 血小板数(最小値) 10万/μl 未満;1点
- 血小板数(最小値) 5万/μl 未満;2点
- 血小板数(最小値) 1万/μl 未満;3点
③原因不明の発熱/炎症反応高値… 3点満点
- 発熱37.5℃以上38.0℃未満 または CRP 2 mg/dl以上,10mg/dl未満;1点
- 発熱38.0℃以上39.0℃未満 または CRP10 mg/dl以上,20mg/dl未満;2点
- 発熱39.0℃以上 または CRP 20 mg/dl以上;3点
④腎障害… 3点満点
- GFR 60ml/min/1.73m2 未満;1点
- GFR 30ml/min/1.73m2 未満;2点
- GFR 15ml/min/1.73m2 未満または血液透析を要する;3点
以上、①〜④で合計12点満点とし
0−4;軽症(grade 1)
5−6;中等症(grade 2)
7−8;やや重症(grade 3)
9−10;重症(grade 4)
11−12;最重症(grade 5)
3)TAFRO症候群の治療ガイド
- 副腎皮質ステロイド(大量);PSL 1mg/kg 2週間 以後漸減維持療法へ
緊急時はm-PSL pulse療法 - Cyclosporin A (CsA) (PSL無効/依存例に併用)
1日量3〜5mg/kgを1日1回又は2回に分けて経口服用を開始。トラフ値(C0)として150〜250ng/mLを目安とする。トラフ濃度がこの範囲に達していても、有効なピークレベルに達していない可能性があるので、できる限り内服2時間後の血中濃度(C2)を測定し、これが600ng/mlに達していない場合はCsA(ネオーラル)を食後内服から食前内服に変更する。血清クレアチニンが投与前値の150%以上に上昇した場合には投与量を半量〜3/4量に減量する。 - Tocilizumab(抗IL-6 receptor 抗体)
多中心性キャッスルマン病合併例で検討 - Rituximab
- TPO受容体作動薬(romiplostim, eltrombopag):血小板減少持続例に考慮
- ・初期治療としてはステロイド、ステロイド不応例に対する二次治療としてはCyclosporin Aを推奨する。
ただし、腎機能障害などでCyclosporin Aを行い難い場合はTocilizumab、Rituximabも考慮する。 - ・血漿交換、Cyclophosphamide、CHOP療法などの多剤併用化学療法、Thalidomide、Lenalidomideなどは少数例の
- 治療成功例が報告されている。
- ・摘脾、大量ガンマグロブリン療法は、現時点では有効例の報告がない。
- ・本治療指針はこれまでの報告例と経験に基づいて作成され、現時点でのエビデンスは乏しい。
- ・本疾患自体には保険承認がある薬剤は現時点(2018年7月)では無く、各病態において保険適応を確認しながら使用
- すべきである。